서론
당단백 VI (GPVI) 결핍은 1987년 면역성혈소판감소증 환자에서 처음 보고되었다. 환자의 혈소판은 콜라겐에 대해 응집하지 않았으며, 환자의 자가항체에 의해 검출된 62 kDa 단백질은 나중에 GPVI로 확인되었다[1]. 이후 여러 연구를 통해서 이 당단백은 콜라겐에 대한 주요 신호전달 혈소판 수용체로 밝혀졌다. 혈소판 표면수용체 GPVI는 리간드 결합시 유발되는 신호전달과정(signal transduction cascade)에서 ITAM (immunoreceptor tyrosine-based activation motif)이라 불리는 모티프(motif)를 통해서 혈소판활성을 유발한다. 최근 섬유소(fibrin)가 GPVI의 리간드로서 작용한다는 보고는 혈전 및 지혈 과정에서 GPVI의 새로운 기능에 대한 연구의 필요성을 제기한다[2,3]. GPVI는 지혈과정보다 혈전형성 과정에서 더 중요한 역할을 한다는 측면에서 혈전성질환의 치료제 개발을 위한 중요한 표적이기도 하다. 여기서는 GPVI 수용체에 대한 개요를 제공하고 혈소판 기능과 관련한 역할과 지혈, 혈전 및 염증과정에서 혈관의 온전성(vascular integrity) 유지와 관련해서 그 역할을 간단히 기술하고자 한다.
구조
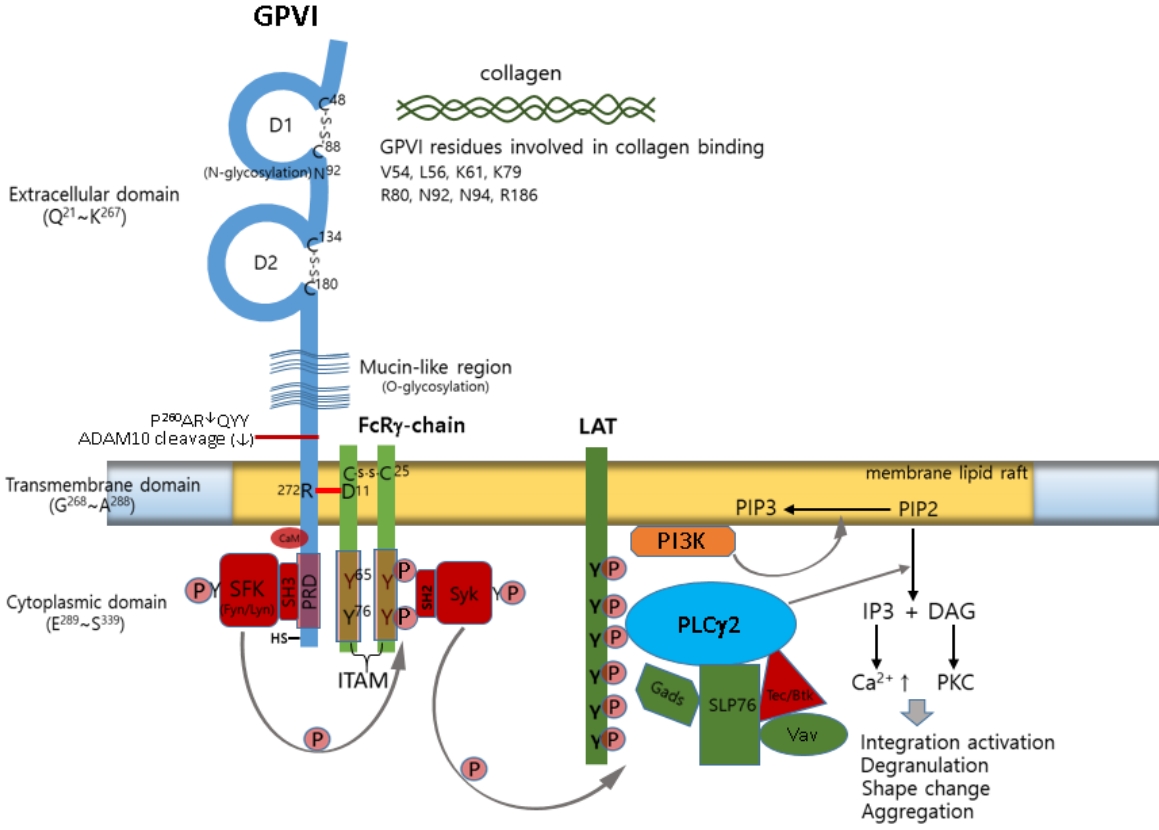
사람과 마우스 GPVI는 1999년과 2000년에 각각 처음 클로닝되었다. GPVI는 하전된 막관통 Arg272을 통해 FcRγ-사슬과 연결될 수 있는 면역글로불린 수퍼패밀리 단백으로 발견되었다. GPVI의 아미노산 서열은 인간과 마우스가 유사하며(67.3% 일치), 둘 다 동일한 전체 도메인 구조를 가진다[4]. GPVI는 I형 막관통단백(type I transmembrane protein)으로서 세포외 도메인은 단백질의 아미노말단에서 시작한다. 세포외 부분의 주된 특징은 D1, D2로 불리는 2개의 면역글로불린-유사 C2 도메인 루프이다. 이들 2개의 도메인은 혈소판 표면으로부터 O-당화(glycosylation) 부위가 풍부한 줄기(stalk)부분 다음에 위치한다. D1 도메인에는 1개의 N-당화가 인간 및 마우스의 Asn92 및 Asn93 위치에서 각각 발견된다. 마우스 GPVI는 Asn244에도 N-당화부위가 있다[4,5]. 줄기도메인의 막 근처에 있는 부분(P260AR^-QYY)은 ADAM (A disintegrin and metalloproteinase) 패밀리금속단백분해효소에 의해 절단되면 GPVI의 세포 외 도메인(soluble GPVI)이 혈소판 표면으로부터 떨어져 나간다[6]. 줄기(stalk)영역에서 19개의 아미노산으로 구성된 막관통도메인의 하전된 Arg272는 FcRγ-사슬의 Asp11과 염교(salt bridge)로 연결되어 FcRγ과 GPVI 사이를 매개한다[7]. 세포질 도메인에는 막에 인접한 칼모둘린-결합 기본모티프(calmodulin-binding basic motif)이 있다. 또한 세포질 부분의 프롤린-풍부도메인(proline-rich domain)은 SFK(Src family kinase)의 SH3 (Src homology 3) 도메인과 결합한다(Fig. 1)[8]. GP6 (GPVI유전자)는 사람에서는 19번 염색체 장완(19q13.4)에, 마우스에서는 7번 염색체의 장완(7qA1)에 위치한다. 사람의 GP6 유전자는 GP6a 및 GP6b라고 하는 두 개의 다른 대립유전자(alleles)을 가지며 인구집단에서 각각 0.85 및 0.13의 정도의 빈도를 보인다. 대립유전자들은 7개의 단일 뉴클레오티드 다형성의 일배체형으로 구분되며, 그 중 5개는 줄기(stalk) 도메인과 세포질 도메인에서 GPVI 아미노산 서열의 변화를 일으킨다.
리간드(Ligand)
GPVI는 콜라겐에 대한 혈소판 수용체로 잘 알려져 있으며, 혈소판 활성화를 유발하며 적어도 부분적으로 GPVI 신호를 이용하는 리간드들이 점점 많이 확인되었다. 사람에서 GPVI에 결합할 수 있는 리간드는 내인성과 외인성으로 나뉜다. 내인성 리간드에는 콜라겐, 섬유소, 섬유소원, α5-라미닌, 파이브로넥틴, 비트로넥틴, EMMPRIN (CD147), 아디포넥틴, 아밀로이드 Aβ40 등이 있고, 외인성 리간드에는 CRP (collagen-related peptide), convulxin, diesel exhaust particles, sulfated polysaccharides 등이 있다[9]. 콜라겐의 9가지 유형이 혈관계에 존재하지만 I과 III 유형의 콜라겐만 큰 피브릴(fibrils)을 형성하고 GPVI에 높은 친화력으로 결합할 수 있다. 이 결합은 콜라겐의 짧은 글리신-프롤린-하이드록시프롤린(GPO)n의 탠덤반복(tandem repeats)에 의해 매개되는데, 이 GPO 탠덤반복 단위는 합성 GPVI 리간드인 콜라겐-관련 펩타이드(collagen related peptide, CRP)을 구성하는 기본 아미노산서열이다. GPVI-콜라겐 상호작용의 정확한 내용은 아직 밝혀지지 않았으나, GPVI에는 두 개의 콜라겐 결합부위가 알려져 있다. 하나는 D1-면역글로불린도메인에 위치한 부위로 돌연변이 연구를 통해 확인되었고, 다른 하나는 GPVI D-도메인의 결정구조에 의해 확인된 것으로 D1–D2 경계에 가까운 힌지(hinge)영역에 위치하고 GPVI가 이량체(dimer)로 군집화된(clustered) 경우에 형성된다[9]. 결정구조에서 확인된 얕은 홈의 간격과 방향은 콜라겐의 삼중나선구조와 일치하여 GPVI 이량체가 콜라겐에 높은 친화력을 갖는 이유를 설명해 준다. 반면에 단량체는 친화력이 약하고 콜라겐에 의한 혈소판 활성화을 유발하지 않는 것으로 생각된다[10]. 최근 섬유소가 GPVI의 새로운 리간드로서 보고되었지만 추가적인 연구가 필요해 보인다[2,3,11].
신호전달경로
GPVI단백은 하전된 막관통 Arg272을 통해 FcRγ-사슬과 연결되어 GPVI 수용체 복합체로서 기능을 한다[12]. GPVI에는 시그널링모티프(signaling motif)가 없기 때문에 GPVI-리간드 결합에 의해 유발되는 전형적인 ITAM 신호경로는 FcRγ-사슬의 ITAMs이 담당한다. FcRγ-사슬은 GPVI 신호전달에 필수적이며 혈소판 표면에 GPVI의 발현에도 필요하다[13]. ITAM (Yxx-LX6–12YxxL)은 6-12개의 아미노산이 중간에 삽입된 2개의 YxxL/I 시퀀스를 특징으로 하며, 다양한 면역수용체, C형 렉틴수용체, 렉틴-유사수용체들에 의해서도 신호전달에 관여한다. 리간드(콜라겐) 결합 후 GPVI가 이량체를 형성하면 세포질내 프롤린-풍부 도메인을 통해 Lyn, Fyn과 같은 SFK가 결합한다. 이 결합체는 ITAM의 티로신 잔기를 인산화 시킨다. Tyr-인산화된 ITAM에 Syk의 SH2 도메인이 결합하면 Syk 키나제가 활성화되는데 여기에는 Syk의 자가 인산화 및 SFKs의 추가 작용이 필요하다. 활성화된 Syk에 의해 여러 어댑터(adapter) 단백[SLP-76 (SH2 domaincontaining leukocyte phosphoprotein of 76 kDa), LAT (linker for activated T-cells), Grb2, Gads]과 인산화효소[Tec family kinases (Btk/Tec), PI3K]가 관여된 단계적 반응이 시작되어 PLCγ2 (phospholipase C-γ2)가 세포질막으로 이동해서, 인산화되고 활성화된다. PLCγ2는 PIP2 (phosphatidylinositol 4,5-bisphosphate)를 DAG (1,2-diacylglycerol)와 IP3 (inositol 1,4,5-trisphosphate)로 가수분해한다. DAG는 PKC (protein kinase C)를 활성화시키고 IP3는 혈소판내 저장소로부터 Ca2+을 유리시켜서 TxA2 생성, 과립분비, inside-out 신호, 인테그린(αIIbβ3) 활성이 일어나게 된다(Fig. 1)[14].
신호전달의 조절
GPVI 수용체는 여러 방식으로 세포막에서 조절된다. ITAM 신호에 영향을 미치는 GPVI 이량체화에 이은 군집화, 세포막 내 GPVI의 분포와 이동을 조절하는 막마이크로도메인(membrane microdomains), 혈소판 GPVI 표현을 제어하는 배출(shedding) 등의 기전들에 의해서 혈소판의 민감도와 시그널링에 영향을 끼친다. GPVI 단백은 리간드 결합시 이량체화를 거쳐 고차원의 군집(cluster)을 이루고 군집화의 정도는 직접적으로 신호의 강도와 리간드 친화력에 영향을 준다[15,16]. 형광현미경 기술의 발달로 인해 활성화된 혈소판에서 GPVI의 위치와 클러스터링역학(clustering dynamics)을 시각화 할 수 있었다. 따라서, 자극하는 콜라겐성 기질에 따라 GPVI가 뚜렷한 군집패턴을 형성할 수 있으며 보다 조밀하게 군집화 된 GPVI는 또한 인산화티로신이 풍부함이 밝혀졌다. GPVI 군집화(clustering)가 신호발생에 영향을 주므로 GPVI의 공간적 분포(spatial organization)에 대한 조절은 신호결과를 제어하는데 역할을 한다[17]. 여러 연구를 통해서 비활성 혈소판 표면에서 GPVI는 20% 정도까지 이량체화 되어 있음이 밝혀졌고, 이러한 현상은 혈소판은 GPVI 활성화를 위해 준비되어 있음을 보여준다. 비활성 혈소판의 GPVI 이량체와 혈소판막을 가로지르는 GPVI의 공간적 분포는 다이나믹 액틴(dynamic actin), 테트라스파닌(tetraspanin) 수퍼패밀리 단백질 및 지질 마이크로도메인에 의해 조절된다[16,18,19]. 약물치료 또는 유전자 녹아웃으로 이러한 조절제 중 하나를 파괴시키면 콜라겐과 CRP에 대한 혈소판의 민감성에 영향을 미친다. 세포막에서 GPVI 분포 및 확산을 평가하기 위해서 적분현미경 및 생화학적 접근법을 사용하면 GPVI 신호발생에 지질뗏목(lipid rafts)과 같은 구조의 역할과 혈소판막에서 GPVI의 공간적 분포(spatial organization)가 어떻게 혈소판 반응과 활성화에 기여하는가에 대한 연구에도 도움이 될 수도 있을 것이다. 사람과 마우스 모두 GPVI 줄기도메인(stalk domain)에 있는 특정 부분(P260AR^QYY)이 ADAM패밀리금속단백효소에 의해 잘리면 활성화된 혈소판 표면으로부터 세포 외 도메인이 떨어져 나간다. 사람에서 GPVI shedding은 주로 ADAM10에 의한다. GPVI shedding을 유발하는 요인(trigger)은 혈소판 활성화 및 세포 내 Ca2+ 농도와 연관된다. 또한 수용체-매개 혈소판 활성화, 높은 전단력, 응고계 활성화 등도 유발요인이 될 수 있다. 55 kDa의 sGPVI에 대한 생물학적 기능은 아직 잘 알려져 있지 않다. 또한 GPVI는 혈소판이 활성화될 때 ADAM10과 같은 셰다아제(sheddase)에 의해 표적화되는 혈소판 표면의 유일한 수용체가 아니다. 그럼에도 불구하고, sGPVI가 고농도로 여러 질병에서 혈액 내에서 검출되기 때문에 shedding에 의한 GPVI의 하향조절(downregulation)은 많은 연구의 대상이 되고 있다[20].
기능 및 역할
GPVI를 발현하지 않는 마우스14와 GP6 유전자 돌연변이 환자들은 심각한 출혈경향을 보이지 않고 외견상 거의 정상적인 지혈작용을 보인다. GPVI 결핍이 희귀한 질환으로 알려진 원인 중 하나는 출혈이 경미해서 진단율이 낮기 때문일 수도 있다. 뚜렷한 출혈을 보이는 일부 GPVI 결핍환자들은 면역성혈소판감소증과 같은 질환을 수반하고 있다[21]. 다양한 GPVI 녹아웃마우스의 동맥혈전증 모델에서 혈전에 의한 혈관폐색이 일어나지 않는 점으로 보아 GPVI는 지혈과 달리, 혈전증에서 중요한 역할을 하는 것으로 보인다[22,23]. GPVI가 결핍되면 혈전형성의 시작은 영향을 받지않고, 대신 혈전의 성장과 안정성이 감소된다[3]. 이는 이들 혈전증 모델에서 GPVI의 주된 기능이 대표적 리간드인 콜라겐이 위치하는 손상된 혈관벽에만 국한되지 않을 수 있음을 시사한다. 사람에서 생기는 동맥혈전증의 중요한 유형은 진행되어 파열된 죽상경화반(atherosclerotic plaque)이다. 진행성 죽상경화반의 섬유질캡(fibrous cap)의 주성분이 콜라겐이라는 점은 GPVI가 혈소판을 활성화시켜 혈전증을 유발하는 요인이라는 것과 함께 혈전질환에서 GPVI 표적화의 근거를 제공한다. 심혈관 질환 환자들을 대상으로 한 연구에서 GPVI 발현 정도의 증가는 급성관동맥증후군 환자의 예후 악화와 상관성이 있었다[24]. 또한 다양한 심혈관 질환과 비심혈관 질환 환자들의 거의 모든 경우에서 sGPVI는 대조군에 비해 증가하여 손상의 정도와 상관성이 있는 것으로 밝혀졌다. 일반적으로 이것은 혈소판 활성화로 인한다고 생각되지만, 혈소판 기능과 관련하여 GPVI shedding에 관해서는 향후 더 연구가 필요할 것이다. 현재 sGPVI는 환자를 층화하고 경과를 모니터링 할 수 있는 바이오마커로서의 가능성에 초점이 모아지고 있다.
염증/혈관온전성, 혈전염증, 감염
혈소판이 감소되면 염증부위에 출혈을 일으키는 것으로 미루어 혈소판은 국소 염증부위의 혈관을 온전하게(vascular integrity) 유지하는데 관여한다[25]. 염증반응을 통해 내피세포의 기저막이 손상되면 호중구의 이동(neutrophil diapedesis) 후 혈액에 노출되는 내피하기질(subendothelial matrix)에 단일 혈소판이 부착하여 부종 조직으로의 출혈을 방지한다. 이 과정은 전형전인 지혈과는 달리 αIIbβ3가 관여하지 않아 혈소판응집으로 인한 혈전 형성으로 이어지지 않으며, 주로 모세관 후 세정맥에서 일어난다. 염증과 관련하여 GPVI는 염증부위의 혈관벽으로 혈소판과 백혈구를 모으고, 혈관투과성과 백혈구활성화를 조절하며, 염증성 출혈을 방지하는데 관여한다. 특히, 피부와 폐의 염증모델에서 GPVI는 염증성 출혈을 방지하는데 매우 중요한 역할을 담당한다[26]. 피부와 폐에서 혈소판은 염증부위로 초기에 모여들어 부분적으로 GPVI를 통해 백혈구 누출(diapedesis)에 의해 만들어진 소혈관 내피간극을 메워서 출혈을 방지한다. 이러한 과정은 혈관투과성이 증가하거나 중성구의 혈관누출이 일어나는 부위에서 발생한다. 피부와 폐에서 관찰된 염증성 출혈과정에서 GPVI의 중요한 역할이 모든 기관의 염증관련 지혈에 필요하지는 않다. 또한 염증과 관련된 지혈반응에서 CLEC-2와 같은 수용체가 GPVI의 역할을 부분적으로 보완하고, 혈소판의 강력한 기능으로 인해 마우스 실험에서 염증성 출혈은 아주 심한 혈소판감소증에서만 관찰되고, 혈소판 표면에 아주 소량의 GPVI만 있어도 정체된(static) 상황에서는 콜라겐에 부착이 가능하다는 점 등으로 인해 염증성 출혈은 GPVI 결핍 환자에서 흔하게 일어나지는 않는다[27].
일차지혈 및 염증과정에서 혈관을 보호하는 역할 외에도 혈소판은 손상부위의 활성화된 내피세포 주위로 면역세포들을 모으는데 관여한다. 염증과 혈전사이에서 세포들의 이러한 상호작용을 혈전염증(thromboinflammation)이라 일컫고 그 과정은 죽상경화증, 허혈–재관류 손상, 무균성 염증을 포함한 병태생리학적 과정에서 매우 중요하다. 혈전염증과정에서 GPVI의 역할은 여러 동물모델에서 확인되었지만 일반적으로 그러한 기능을 어떻게 중재하는지는 여전히 불분명하다. 죽상경화증과 허혈-재관류 손상의 경우, GPVI를 차단 또는 억제시키면 지혈과정에 영향없이 보호하는 효과가 있다. 이러한 효과에는 죽종형성(atherogenesis) 과정에서 경화반(plaque)의 크기감소, 경색의 크기감소, 뇌와 심장의 미세순환관류 개선 및 전반적인 면역세포침윤 감소 등이 있다[28,29]. 무균염증(sterile inflammation)의 마우스모델에서 GPVI는 염증성 사구체에 혈소판부착을 직접 매개하거나 혈소판분비와 미세소포의 분비를 통해 면역세포와 섬유모세포를 간접적으로 조절하는 유해한 역할도 한다.
표적약물
항혈전 약물의 주요 특성은 지혈작용에 큰 영향을 주지 않고 혈전을 줄이는 점이다. GPVI 길항제는 일차지혈과정에는 큰 영향을 미치지 않고 혈전증을 효과적으로 억제하는 것으로 보고되었다. 따라서 혈전형성을 유발하는 것으로 확인된 GPVI는 혈전성 질환에서 좋은 표적이 되고 있다. 현재 GPVI를 표적으로 하는 방법은 GPVI-콜라겐 상호작용 차단, GPVI 차단/억제, GPVI 신호전달차단의 3가지로 요약된다. 수용성 이량체(soluble dimer)인 GPVI-Fc 융합단백(Revacept)은 정맥투여가 가능하며, 혈소판 GPVI의 결합부위를 차단하는 재조합 GPVI-세포외도메인 두 개가 포함되어 있어서 혈소판 GPVI에 의해 유발되는 혈전성 질환을 방지하는 GPVI 길항제 역할을 한다[32]. 현재 Revacept는 스텐트 삽입을 하고 있는 안정적인 관상동맥질환 환자와 증상이 있는 경동맥 협착 및 뇌졸중과 같은 일시적 허혈성 질환 환자들을 대상으로 임상 2상을 진행 중에 있다[33]. GPVI를 차단하는 인간화 Fab분절(humanized Fab fragments), GPVI에 대한 단클론항체, GPVI 신호전달경로의 중요한 키나제억제제도 항혈전 약물의 가능성을 보여준다[34].