일시적 위험인자가 없는 폐색전증에서 혈액응고 관련 인자들의 변화
Alteration of Factors Associated with Coagulation in Provoked Pulmonary Embolism
Article information
Trans Abstract
Purpose
Pulmonary embolism (PE) is regarded as a form of deep vein thrombosis. Although the recurrence rate of venous thrombosis in provoked embolism is lower than it is in unprovoked vein thrombosis, proteins associated with coagulation have not been well studied in provoked PE. This study sought to evaluate factors associated with coagulation between provoked and unprovoked PE.
Methods
This retrospective cohort study included 207 PE patients. Patients that had transient risk factors at diagnosis were included in the provoked PE group, while all others were classified as unprovoked PE. Evaluation of proteins associated with coagulation included protein C, protein C activity, protein S, protein S free form, protein S activity, antithrombin III, factor VIII, and factor IX.
Results
Among 207 PE cases, 65 (31.4%) cases were diagnosed as provoked PE. Clinical characteristics were not significantly different between provoked and unprovoked PE. However, RV/LV ratio was significantly higher in provoked PE than it was in unprovoked PE. Proteins and activity associated with coagulation were significantly lower in provoked PE than in unprovoked PE: protein C antigen (33% vs. 54%, P= 0.01), protein S antigen (31% vs. 53%, P= 0.001), protein S activity (55% vs. 71%, P< 0.001), antithrombin III antigen (61% vs. 79%, P< 0.001), and factor VIII (160% vs. 184%, P= 0.01).
Conclusion
Provoked PE had significantly lower anti-coagulation protein levels and activity than unprovoked PE.
서론
정맥혈전증은 진단 시 항응고제 치료 중단 후의 재발위험도에 따라 분류 되고 이에 따라 치료 기간이 달라지게 된다.[1] 재발위험도는 유발인자 유무에 따라 달라 일시적인 위험인자가 있는 정맥혈전증(provoked VTE)과 일시적 위험인자가 없는 정맥혈전증(unprovoked VTE)으로 나뉜다.[1] 일시적 유발 인자가 있는 정맥혈전증(provoked VTE)은 수술 후 발생한 경우와 수술과 관련이 없는 경우에서 재발 위험도가 다르게 나타나며, 최근 1개월 이내 수술을 받았던 위험인자가 있었던 경우는 유발인자가 있는 정맥혈전증(provoked VTE by surgery), 에스트로겐 치료, 임신, 다리외상, 8시간 이상의 비행과 같은 일시적인 비수술적 유발인자가 있었던 경우는 비수술적 유발인자가 있는 정맥혈전증(provoked VTE by a non-surgical reversible risk factor)으로 분류된다.[2] 폐색전증(pulmonary embolism, PE)은 정맥혈전증의 연장으로 간주되고 분류도 정맥혈전과 같다.
Virchow에 따르면 정맥혈전증은 혈류의 정체(stasis), 응고항진성(hypercoagulability), 혈관내피손상(endothelial dysfunction)으로 설명할 수 있다.[3] 하지정맥의 경우 정맥혈류가 근육의 수축에 따라 정맥이 수축되어 혈류가 생성되지만, 폐동맥의 경우 이러한 근육수축에 따른 혈류의 변화가 없다. 말초정맥 압력이 중심정맥압과 거의 압력이 일치하는 것으로 본다면,[4] 폐동맥압은 중심정맥압에 비해 2-3배 이상 높으며 따라서 혈류도 빠른 것으로 바꾸어 생각할 수 있다. 또한 폐동맥은 하지정맥과는 달리 근육에 의해서 펌프작용에 의해 순환하는 작용이 없다. 폐순환에서 폐동맥은 전체 폐순환 저항의 46%를 차지하고 있다.[5] 이러한 관점에서 본다면 정맥혈류의 정체(stasis)는 하지정맥과 폐동맥에서는 다르다고 볼 수 있다. 혈류의 차이가 있다면 동맥혈에서 혈액응고인자가 혈관내에 머무르고 있는 시간이 짧아 상대적인 농도가 낮듯이, 하지 정맥에 비해서 폐동맥 내에서 혈액응고인자의 노출 강도가 낮을 것으로 추측할 수 있다. 또한 외부의 압력이나 상처 및 기타 외인성 손상에 영향이 거의 없을 것으로 생각되는 폐동맥의 경우 상대적으로 혈관손상의 기회가 거의 없을 것으로 보인다. 이에 폐동맥혈전증(폐색전증)이 발생했다면 다른 곳에서 발생한 정맥혈전증이 이동한 것으로 유추하여, 일반적으로 폐동맥혈전증은 정맥혈전증의 연장으로 고려된다. 그러나 만성폐색전증 등의 예로 보아 폐동맥혈전증의 경우 하지정맥혈전증과 일부 다른 병태 생리를 가질 것으로 판단된다.[6]
일시적 위험인자라 함은 Virchow가 언급한 세가지 위험인자가 일시적으로 발생한 경우로 해석할 수 있는데, 하지정맥혈전증과는 달리 폐동맥 혈전증의 경우 이러한 일시적 위험인자가 있는 군과 없는 군 사이의 임상 양상의 차이가 있는지, 그리고 혈액 응고와 관련된 인자의 변화가 있는지 등에 대해서는 연구가 많지 않다. 또한 혈장응고인자들과 정맥혈전질환과의 연구가 많이 이루어져 있지만, 유발인자가 있으면서 발생한 정맥혈전과 유발인자가 없는 경우에 발생한 경우를 비교한 연구는 잘 되어 있지 않다. 이에 이 연구는 폐색전증에서 유발인자 유무에 따라 응고인자의 차이가 있는지를 확인하고자 하였다.
방법
연구대상
본 연구는 의학연구윤리심의위원회의 승인을 받아 시행되었다. 2005년 1월부터 2011년 12월까지 입원 및 외래 환자 혹은 응급실 방문 환자 중에서 컴퓨터단층촬영 폐혈관조영술(Computed Tomography Pulmonary Angiography, CTPA)을 시행한 후 폐색전증으로 확진받은 환자 667명의 환자 중에서 혈전성향증(thrombophilia) 조사를 위해 혈액응고와 관련된 인자를 측정한 207예를 대상으로 하였다. 모든 환자는 폐색전증이 처음 진단된 환자를 대상으로 하였으며, 만성 폐색전증 환자는 제외하였다.
연구방법
본원에서 폐색전증의 진단은 임상적으로 폐색전증이 의심되는 환자에서는 Siemens사의 16 또는 64개의 검출기를 가진 스캐너를 이용하여 CTPA를 시행하고, CTPA에서 폐색전증의 소견이 관찰되지 않은 경우 폐색전증이 없는 것으로 해석하였다. 환자가 심부정맥 혈전을 가지고 있으면서 호흡기 증상이 동반된 경우 다시 CTPA로 폐색전증 유무를 평가하였다. 신부전이 있거나 조영제에 부작용의 병력이 있는 경우 폐환기관류 스캔을 시행하였다. CTPA 판독은 폐동맥 중심부 혹은 주변부의 충만결손(filling defect)이 있을 때 폐색전증으로 진단하였다. NT pro-BNP (N-terminal prohormone of brain natriuretic peptide)는 207명의 환자 중 128명에서 측정이 되었으며 흉부 전산화 단층 촬영이나 폐혈관 전산화 단층 촬영을 시행한 198명의 환자에서 우심실/좌심실 직경비를 측정하였다.
응고억제인자 및 응고인자의 측정
폐색전증의 진단 후 혈액을 3.7% sodium citrate 채혈관에 채취하여 분석 하였다. C단백 활성도와 S단백 활성도는 응고인자 5번(factor V, FV)을 기질로 사용하여 응고 기능을 평가하여 측정하였다(Diagnostica Stago, Asnieres, France). 혈장의 C단백, 총 S단백(total protein S), 유리단백S (free protein S)는 방사면역확산(radial immunodiffusion)법으로 측정하였다. 항트롬빈 III, 응고인자 8번(factor VIII, FVIII), 응고인자 9번(factor IX, FIX)은 자동화 혈액응고분석기(ACL Top 500, Intstrumentation Labroratry, Bedford, USA)를 이용하여 측정하였다.
응고억제인자 결핍증의 분류
응고억제인자 결핍증의 유형은 다음과 같이 분류하였다. 단백 결핍과 활성도 감소의 기준은 50% 이상 감소한 경우로 정의하였다.[7,8] C단백 결핍의 경우 1형(type 1)은 기능적 활성도(functional activity)와 항원량이 같이 감소된 경우이고, 2형(type 2)은 기능적 활성도는 감소되어 있으나 항원의 농도는 정상인 경우로 하였다. S단백 결핍의 경우 기능적 활성도는 감소되고 S단백의 유리형 항원과 총 항원량이 같이 감소된 경우를 1형(type 1), 기능적활성도는 감소되고 S단백의 유리형 항원과 총 항원량이 정상인 경우를 2형(type 2), 기능적 활성도가 감소되고 S단백의 유리형 항원은 감소 되었지만 총 항원량은 정상인 경우를 3형(type 3)으로 하였다.
통계
연속변수는 평균과 표준편차로 표시하였다. 양군의 비교에서 연속변수는 Student t-test로 비연속 변수의 비교는 Chi-square test로 유의 수준 0.05 미만일 때 통계적으로 유의한 것으로 판정하였다. 통계프로그램은 SPSS 20.0 (SPSS Inc., Chicago, IL, USA)을 사용하였다.
결과
일시적 위험인자를 가진 환자 중에서 수술과 관련된 예는 25예이었고, 61예에서 고정(immobilization)과 연관되었고, 수술과 고정 두 가지 위험인자를 모두 가진 환자는 21예였다. 일시적 위험인자가 없는 경우는 142예였다.
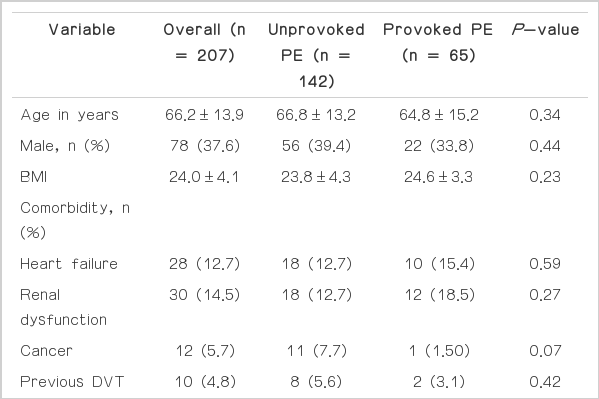
폐색전증으로 진단된 207명의 환자 중 입원 30일 이내에 사망한 환자는 9명(4.3%)이었다(Table 1). 일시적인 위험인자(provoked)를 가진 폐색 전증군과 일시적인 위험인자를 가지지 않은(unprovoked) 환자군을 비교 했을 때, 나이, 성별 및 비만도에서는 유의한 차이를 보이지 않았다. 진단 받은 당시 환자가 가지고 있는 기저질환을 비교하여 심부전, 신기능 이상 유무, 활동성 암의 유무 및 이전 심부정맥혈전증이나 폐색전증의 병력에서 두 군 간의 유의한 차이는 보이지 않았다. 내원 당시 두 군 간의 임상 증상 및 활력 징후를 비교하여 객혈이나 흉통의 유무는 두 군 간의 유의한 차이가 없었다. 수축기 평균혈압은 양군에 차이가 없었으며 쇼크의 빈도도 두 군 간 유의한 차이를 보이지 않았으나, 일시적인 위험인자를 가진 폐색전증 환자에서 쇼크의 빈도가 높은 경향을 보였다.
두 군에서 입원 당시 측정한 NT pro-BNP와 말초 혈액 백혈구는 유의한 차이를 보이지 않았지만, 우심실/좌심실 직경비는 일시적인 위험인자를 가진 폐색전증군에서 일시적인 위험인자를 가지지 않은 폐색전증군에 비해 24%정도 더 증가되었다.
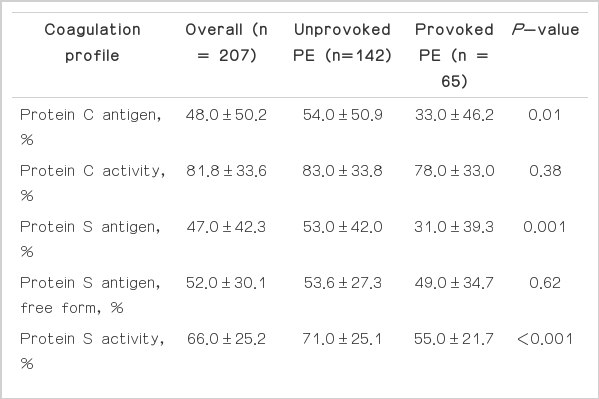
혈장 C단백의 참고범위는 항원량 72-160%, 활성도 70-130%이었고, 혈장 S단백의 참고범위는 총항원량 60-150%, 유리형 항원량 50-150%, 활성도 73.7-146.3%이였다. 혈액응고인자 분석에서 C단백 항원, S단백 항원, S단백 활성도, 항트롬빈 III, FVIII 등이 일시적인 위험인자를 가진 폐색전증군에서 유의하게 낮았다(Table 2). C단백의 경우 일시적인 위험인자를 가진 폐색전증군이 일시적인 위험인자를 가지지 않은 폐색전증군에 비해 40% 정도 유의하게 낮았으나 C단백의 활성도는 유의한 차이가 관찰되지 않았다. S단백의 경우에서도 일시적인 위험인자를 가진 폐색전증군이 일시적인 위험인자를 가지지 않은 폐색전증군에 비해 42% 낮았고, S단백 활성도는 23% 정도 유의하게 낮았으나 S단백 유리형 항원은 유의한 차이가 관찰되지 않았다.
항트롬빈 III는 일시적인 위험인자를 가진 폐색전증군에서 일시적 위험인자를 가지지 않은 군에 비해 평균 18% 낮았고, FVIII의 경우 일시적인 위험인자를 가진 폐색전증군에서 일시적 위험인자를 가지지 않은 군에 비해 평균 24% 낮았다.
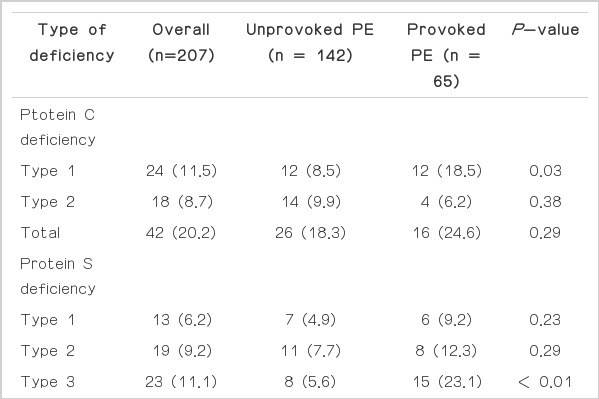
S단백 응고억제인자 결핍의 유형은 일시적인 위험인자를 가진 폐색전증에서 C단백의 활성도와 항원량이 같이 감소한 1형(type 1)의 빈도가 일시적 위험인자를 가지지 않은 폐색전증에 비해 유의하게 높았다(Table 3). C단백 응고억제인자 결핍의 유형은 일시적인 위험인자를 가진 폐색전증에서 S단백 활성도와 S단백 유리형 항원량이 같이 감소한 3형(type 3)의 빈도가 일시적 위험인자를 가지지 않은 폐색전증에 비해 유의하게 높았다.
고찰
본 연구에서 응고 억제에 관여하는 C단백과 S단백 항원, S단백 활성도, 항트롬빈 III 등이 일시적인 위험인자를 가진 폐색전증에서 일시적인 위험인자를 가지지 않은 폐색전증에 비해 유의하게 낮았다. 또한 FVIII의 농도도 일시적인 위험인자를 가진 폐색전증군에서 일시적인 위험인자를 가지지 않은 폐색전증군에 비해 유의하게 낮았다.
C단백 결핍증의 경우 정맥혈전의 위험성을 8-10배 정도 높인다.[9] C단백과 S단백 결핍의 역학은 대상 환자군에 따라 차이가 있는데, 건강인에서는 결핍의 빈도가 매우 낮지만, 50세 미만의 재발성 심부정맥혈전증 혹은 가족력이 있는 환자군에서는 C단백 결핍의 빈도가 4.8%, S단백 결핍의 빈도가 4.3%로 높게 관찰된다.[10] 심부정맥혈전증 환자에서 C단백 결핍은 113예 중 10예(9%), S단백 결핍은 113예 중 21예(19%)로 높게 관찰된 바 있다.[11] 국내에서는 정맥혈전증에서 C단백 결핍증은 10.3%, S단백 결핍증은 6.9%로 관찰되었고,[12] 폐색전증 연구에서는 C단백 결핍은 9.5%, S단백 결핍은 19%로 관찰된 바 있다.[13] 만성폐색전증 환자에서는 C단백 결핍 환자는 20명 중 5명(25%)이었고 S단백 결핍 환자는 20명 중 1명(5%)이었다.[14] 본 연구에서는 C단백 활성도가 50%이상 감소한 군을 기준으로 할 경우, 일시적인 위험인자를 가진 폐색전증 16명(24%)에서 C단백 활성도가 감소 되었고, 일시적인 위험인자를 가지지 않은 폐색전증의 경우 26예(18%)에서 C단백 활성도가 감소되었다. 일시적인 위험인자를 가진 폐색전증 환자에서 C단백 활성도 감소는 C단백 결핍과 연관된 것으로 보인다(Table 3). 일시적인 위험인자를 가진 폐색전증 환자의 평균 연령이 65세인 점과 정맥혈전의 과거력이 3%인 점을 고려한다면 후천적인 요인으로 인해 C단백 활성도와 C단백 결핍이 발생한 것으로 보인다.
S단백은 FVa와 VIIIa의 활성화를 방해하면서 체내에서 항응고 역할을 담당하는 중요한 인자로서 결핍 시에는 심부 혹은 표재 정맥 내에 반복적인 혈전 형성뿐 아니라 다양한 장기에서 혈전증이 유발될 수 있다.[15,16] S단 백 결핍증의 유병률은 전체 인구에서 0.16-0.21%, 심부정맥혈전증 환자에서는 약 2%로 보고되어 있으며, S단백 결핍증이 있는 경우는 심부정맥혈전이 발생할 위험성이 5-11.5배 정도 증가되는 것으로 알려져 있다.[16] 본 연구에서는 남자와 여자 모두 50% 이하를 기준으로 결핍증을 정의한 결과 일시적인 위험인자를 가진 폐색전증 29명(44.6%)에서 S단백 활성도가 감소되었고, 일시적인 위험인자를 가지지 않은 폐색전증의 경우 26예(18.3%)에서 S단백 활성도가 감소되었는데, 이는 S단백의 유리형 항원의 감소와 연관이 있는 것으로 보인다(Table 3). 비록 감염의 빈도는 두 군에서 유의한 차이를 보이지 않았으나 환자군의 나이와 정맥혈전의 과거력을 고려할 때 감염 등의 후천적 원인에 의해 혈액응고 억제인자가 감소된 것으로 추측된다.
FVIII이 혈전을 증가시키는 기전은 불명확하지만, 혈장 FVIII의 상승은 정맥혈전의 발병의 위험을 증가시키는 것으로 알려져 있다.[17-19] 본 연구에서는 일시적인 위험인자를 가진 폐색전증의 경우 FVIII의 평균이 정상치 보다는 높았지만, 일시적인 위험인자를 가지지 않은 폐색전증보다는 유의하게 낮았다. 이러한 점에 볼 때 FVIII의 경우 일시적인 위험인자를 가지지 않은 폐색전증에서 혈전형성에 더 관여할 것으로 추측된다. 그러나 일시적인 위험인자를 가진 폐색전증의 경우에도 FVIII이 평균 140% 이상으로 상승되어 있어서,[20] 발생에 일부 관여될 가능성도 있다.
항트롬빈 III의 경우 본 연구에서는 일시적인 위험인자를 가진 폐색전 증군에서 일시적인 위험인자를 가지지 않은 폐색전증에 비해 유의하게 감소되어 있다. 선천적 요인에 의한 감소의 정도는 유전인자 검사를 하지 않아서 확인할 수 없지만, 감염 등의 후천적 요인으로 인해 항트롬빈 III의 감소가 일시적인 위험인자를 가진 폐색전증에서 이루어진 것으로 보인다.
예후 인자를 분석하면, 폐색전증 환자에서 사망의 위험인자로 대두되고 있는 백혈구는 양 군에서 유의한 차이를 보이지 않았고,[21] 폐색전중증도지수(pulmonary embolism severity index, PESI) 평균 점수 또한 양군에서 차이가 없었다. 그러나 혈류역학적인 부분에서는 우심실/좌심실 직경비가 일시적인 위험인자를 가진 폐색전증에서 유의하게 높았고, 쇼크의 빈도와 NT Pro-BNP 혈중 농도 또한 일시적인 위험인자를 가진 폐색전증에서 일시적인 위험인자를 가지지 않은 폐색전증에 비해 높은 경향을 보였다. 본 연구에서도 위험인자를 가진 폐색전증군에서 사망률이 높은 경향을 보였으며, 이러한 점들은 기존의 연구에서 일시적인 위험인자를 가진 폐색전증이 사망률이 높았던 점을 고려할 때,[22] 일시적인 위험인자를 가진 폐색전증에서 혈류역학적인 문제를 더 심하게 야기했을 수 있다.[23] 이러한 연구로 PESI 점수는 여전히 혈류역학적 상황이 충분히 고려되지 않은 점을 생각한다면, 일시적인 위험인자를 가진 폐색전증 환자에서는 PESI 점수로만 중증도를 평가하기에는 문제가 있을 것으로 보인다. 일시적인 위험인자를 가진 폐색전증 환자의 경우 더 적극적으로 심초음파 및 NT Pro-BNP 등을 측정하는 것이 필요하겠다.[24]
결론적으로, 이 연구에서는 일시적인 위험인자를 가진 폐색전증군과 일시적인 위험인자를 가지지 않은 폐색전증군을 비교했을 때 혈액응고 억제와 관련된 C단백, S단백, 항트롬빈 III 등이 유의하게 감소된 것을 알 수 있었다. 향후 연구에서 일시적 위험인자를 가진 폐색전증 환자에서 혈액 응고 억제와 관련된 인자의 결핍에 대한 임상적인 의미에 대해서 추가 연구가 필요하다. 또한 혈액응고 억제와 관련된 인자 결핍을 전향적인 연구를 통해 다시 검증할 필요가 있겠다.
Notes
There are no conflicts of interest relevant to this article to report.