광범위 폐색전증에서 혈전용해치료
Thrombolysis in Massive Pulmonary Embolism
Article information
Trans Abstract
Massive pulmonary embolism (PE) is defined as sustained hypotension, not due to the cause other than PE, pulselessness, or persistent profound bradycardia. Therefore, although PE exhibits variable clinical course, massive PE is a life-threatening condition of which in-hospital mortality reaches over 15% and which consequently requires thrombolysis as well as anticoagulation. According to recent guidelines of PE, systemic thrombolysis is recommended over no such therapy in patients with massive PE who do not have a high bleeding risk. Currently, continuous infusion of alteplase over 2 hours plus anticoagulation using unfractionated heparin constitutes a standard regimen. When systemic thrombolysis is failed or contraindicated, patients with massive PE can undergo surgical embolectomy or catheter-directed thrombolysis, if specialist services and expertise are available. In addition, hemodynamic and respiratory supports, including extracorporeal membrane oxygenation, are needed for successful treatment of massive PE.
서론
폐색전증은 심혈관 질환 중 심근경색과 뇌졸중에 이어 세 번째로 흔한 사망원인이다[1]. 미국심장협회(American Heart Association, AHA)는 폐색전증을 초기 사망률의 위험도에 따라서 광범위(massive), 아광범위(submassive), 저 위험(low risk) 폐색전증의 세 단계로 분류하였고[2] 유럽심장학회(European Society of Cardiology, ESC)는 고 위험(high risk), 중 위험(intermediate risk) 및 저 위험 폐색전증으로 구분하였다[3]. 폐색전증의 임상경과는 매우 다양하여 앞서 언급한 세 단계에 따른 병원 내 사망률은 각각 15% 이상, 3-15%, 3% 미만이다[3]. 일반적으로 폐색전증의 치료의 근간은 항응고제 치료이지만 항응고제는 이미 발생한 혈전은 저절로 호전되기를 기다리면서 더 이상 혈전생성이 되지 않도록 예방하기 때문에 광범위 또는 고 위험 폐색전증에서는 항응고제 투여와 더불어 혈전용해치료를 통하여 보다 적극적으로 혈전을 녹이려는 노력이 필요하다.
저자들은 광범위 폐색전증에서 혈전용해치료에 대해서 검토하여 광범위 폐색전증의 정의 및 혈역학적 의의, 혈전용해제의 기전, 종류 및 투여방법, 그리고 체외막산소공급(extracoporeal membrane oxygenation, ECMO)을 포함한 여러 가지 보조요법과 카테터-유도 혈전용해(catheter-directed thrombolysis, CDT), 그리고 외과적 색전제거술 등에 대하여 설명하고자 한다.
본론
광범위 폐색전증의 정의 및 혈역학적 의의
AHA에서 제안한 광범위 폐색전증의 정의는 다음과 같다: 1) 부정맥, 혈량저하(hypovolemia), 패혈증, 또는 좌심부전과 같은 폐색전증 이외의 원인을 배제하고 15분 이상 동안 수축기 혈압 90 mmHg 미만 또는 혈압상승제(vasopressor) 사용이 필요한 경우; 2) 무맥박(pulselessness); 또는 3) 지속적인 심한 서맥(맥박수 40/분 미만)이면서 쇼크의 증상이나 징후가 있는 경우[2]. ESC는 고 위험 폐색전증을 부정맥, 혈량저하, 패혈증으로 인한 경우가 아닌 15분 이상 동안의 수축기 혈압이 90 mmHg 미만 또는 이전보다 40 mmHg 이상 감소한 경우로 정의하였다[3].
International Cooperative Pulmonary Embolism Registry (ICOPER)연구에 따르면 광범위 폐색전증은 전체 폐색전증 환자의 4.5%를 차지하는데[4], 폐색전증으로 인한 사망은 대부분 우심부전으로 인해 발생한다. 혈전이 폐동맥을 막으면 혈역학적 및 가스교환 장애를 초래하는데 이는 폐동맥 폐쇄의 범위, 환자의 심폐예비(cardiopulmonary reserve) 등에 의해 결정된다[5]. 혈전에 의한 직접적인 폐동맥 폐쇄, 저산소혈증 및 혈관수축제 분비에 의해 폐혈관 저항이 상승하면 우심실 후부하가 상승하여 우심실의 압력과부하가 발생하고 이로 인해 우심의 운동저하(hypokinesis) 및 확장, 삼첨판역류, 우심실부전을 일으켜서 우측 심장 박출양의 감소와 심실중격의 좌심실로 치우침을 통해 좌심실 전부하의 감소, 좌심실 심장 박출양의 저하, 전신저혈압(systemic hypotension)을 초래한다. 한편, 폐혈관저항의 상승은 우심실 벽의 장력을 증가시키고, 전신저혈압은 관상동맥의 관류를 저하시켜서 우심실의 허혈을 일으켜 우심실 기능을 다시 악화시키는 악순환을 초래한다.
혈전용해치료 원리
혈전용해의 원리는 우심실의 압력과부하를 감소시켜서 전신적인 동맥의 관류압(perfusion pressure)을 정상화하여 혈역학 장애(hemodynamic compromise)와 가스교환의 이상을 빠르게 회복시키는 것이고, 장기적으로 만성혈색전고혈압(chronic thromboembolic hypertension)의 발생을 줄이는 것이다[5]. 대표적인 혈전용해제인 조직플라스미노겐활성제(tissue plasminogen activator, tPA)을 주사하면 플라나스미노겐(plasminogen)을 플라스민(plasmin)으로 활성화시키고 플라스민이 혈전의 기질(matrix)을 형성하는 섬유소(fibrin)를 용해시켜서 혈전용해를 달성하게 된다.
북미흉부의사학회(American College of Chest Physician, ACCP)의 정맥혈전색전증(venous thromboembolism)에 대한 항혈전치료 10번째 진료지침에서 혈역학 장애가 동반된 광범위 폐색전증 환자에 대하여 출혈의 고위험군이 아니라면 혈전용해치료가 2B 등급(grade: 무작위대조시험의 데이터가 제한적인 것으로 인해 약하게 권고하는 경우)으로 권고된 바있다[6]. 한 메타분석에서 광범위 폐색전증에서 혈전용해치료는 대조군에 비해 폐색전증의 재발 및 사망을 55% 감소시켰다고 보고된 바 있다(9.4% 대 19.0%) [7]. 미국의 입원환자 데이터를 이용하여 혈전용해치료가 폐색전증으로 인한 사망을 42%에서 8%로 감소시켰다는 연구도 광범위 폐색전증 환자에서 혈전용해치료의 정당성을 뒷받침해주고 있다[8].
표준 혈전용해치료
지금까지 미국 식품의약국(Food and Drug Administration)에서 허가된 혈전용해제로는 streptokinase, urokinase, alteplase (tPA의 일종)의 세 가지가 있다(Table 1) [2]. 어느 약제가 가장 치료효과가 우월하다고 알려지지는 않지만 12시간 이상 투여하는 경우에 출혈의 위험이 더 높으며 2시간 정주하는 경우에 피떡(clot)의 용해(lysis)에 더 효과적인 것으로 알려져 있다[9]. 따라서 alteplase를 표준 치료제로 제시하고 있다. 표준요법은 10 mg을 부하투여(bolus loading)하고 90 mg를 2시간 동안 지속 주입한다[10]. 혈전용해치료가 필요한 경우는 항응고제로 저분자량헤파린(low molecular weight heparin, LMWH)보다는 반감기가 짧은 비분획헤파린(unfractionated heparin, UFH)이 권고된다. UFH을 사용하다가 alteplase를 투여할 경우 미국에서는 UFH 사용을 중단하기를 권고하지만, 유럽 등지에서는 UFH를 그대로 유지해도 무방한 것으로 되어있다[3]. 혈전용해제를 투여하면서 UFH를 중단한 경우에는 혈전용해제 투여 직후에 활성화부분트롬보플라스틴시간(activated partial thromboplastin time, aPTT)을 측정하여 80초 미만이면 UFH를 유지용량으로 다시 시작하고 그 이상이면 4시간 뒤 aPTT를 다시 측정하여 상기 조건에 해당되면 다시 시작한다[11]. 폐색전증에서 통상적인 UFH는 부하용량 80 U/kg 투여 후에 18 U/kg/hr 지속정주로 항-Xa 활성 0.3-0.7 U/mL 또는 aPTT 정상범위의 중앙값의 1.5-2.5배를 치료범위로 하지만[9], 광범위 폐색전증의 경우에 대량의 피떡 부하로 인해 보다 고용량의 UFH를 투여해야 한다고 주장하기도 한다(부하용량 최소 10,000 U, 유지용량 1,250 U/hr 이상 그리고 aPTT 80초 이상) [11].
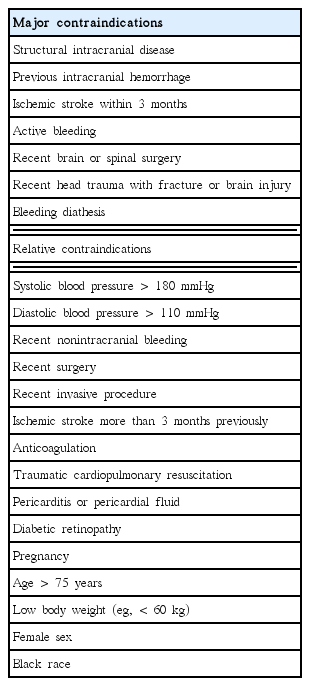
혈전용해치료의 가장 걱정스러운 부작용은 출혈이고, 뇌내출혈은 대략 2-3% 정도이고 대출혈(major bleeding)은 10-20% 정도이다[4]. 혈전용해치료를 하기 전에 고려되어야 할 금기항목은 Table 2와 같다[10]. 그러나 당장의 출혈이 아니면 나머지 금기사항은 모두 비교금기로 간주될 수 있어서 혈전용해치료 여부는 결국 임상의의 판단에 따라 결정되어야 한다[3].
표준요법 이외의 alteplase 투여
Alteplase 표준요법 외에 출혈의 위험도를 낮추기 위해 저용량 alteplase 투여하는 방법(부하용량 10 mg + 40 mg 지속정주)도 있는데, 한 전향적 연구에서 표준요법과 비교하여 사망이나 재발률은 유의한 차이가 없으면서 출혈빈도는 낮은 경향을 보였다[12]. 따라서 저용량 alteplase 투여는 증거가 충분하지 않은 실정이지만 노인이나 저체중 환자에서 유용한 방법이 될 수도 있다. 또 다른 alteplase를 투여하는 방법은 0.6 mg/kg (최대 50 mg)을 부하주사하는 것인데 출혈 및 재발/사망에서 표준요법과 유의한 차이는 없었다[13]. 이 방법은 심정지 상태와 같은 응급상황에서 혈전용해제를 급속히 투여하는 것이 필요할 때 가용한 방법이 될 수 있다[10].
표준요법에서 사용하는 항응고제는 UFH이지만 aPTT를 치료범위에 맞추는 용량조절이 번거로울 수 있기 때문에 UFH 대신에 LMWH을 사용한 연구도 제시된 바 있다[14]. 연구자들에 따르면 UFH + alteplase에 비하여 LMWH + alteplase 사용시에 출혈은 차이가 없었고 30일 사망률은 유의하게 낮게 나타나서 LMWH + alteplase도 하나의 선택사항이 될 가능성이 있다.
광범위 폐색전증에서 보조요법
저혈압을 동반하는 광범위 폐색전증에서 혈전용해와 더불어 다양한 혈역학적 보조요법이 필요할 수 있다. 우심실부전을 동반한 상태이므로 저혈압이 있더라도 과도한 수액투여는 우심실부전을 악화시킬 수 있으므로 초기 수액부하는 500 mL 정도가 적절하고 중심정맥이 확보되어 있다면 중심정맥압이 12-15 mmHg 이하로 유지할 것을 권고한다[3]. 혈압상승제로는 norepinephrine, dobutamine, dopamine, phenylephrine 등이 사용될 수 있는데 특정약제가 다른 것보다 우월하다는 데이터는 없으며, norepinephrine의 경우 우심실의 수축력을 올리면서 폐동맥을 수축시키지 않아서 ESC의 진료지침에서 첫 번째로 언급되는 혈압상승제이다.
혈역학적 보조요법 외에 호흡보조요법도 필요할 수 있는데, 즉 저산소혈증에서 산소를 공급한다. 기계환기는 흉곽 내의 압력을 증가시켜서 우심실기능을 저하시킬 수 있기 때문에 낮은 일회호흡량(tidal volume, <6 mL/kg)을 사용하고 고원압(plateau pressure)은 30 cmH2O 미만을 유지해야 한다[3,5.]
하대정맥 필터 삽입
광범위 폐색전증에서 하대정맥에 필터를 삽입하는 것의 이점을 입증하는 데이터는 아직 충분하지 않은 실정이다. 최근의 한 무작위대조시험에서 중증 폐색전증 환자에서 항응고제 단독 사용에 비해 항응고제와 함께 회수할 수 있는(retrievable) 하대정맥 필터를 사용하더라도 3개월 내에 폐색전증의 재발은 유의한 차이가 없었다[15]. 2016년 ACCP 10번째 진료지침에서도 항응고치료를 받는 폐색전증 또는 심부정맥혈전증에서 하대정맥 필터 삽입은 권고되지 않고 있다[6]. 그러나 혈전용해치료, 수술적 색전제거술, CDT가 금기인 경우는 하대정맥필터가 필요하며, 수술적 색전제거술 시행 전에도 보통 시행하는 것으로 알려져 있다[5]. 같은 맥락에서 ICOPER 연구에 따르면 광범위 폐색전증에서 하대정맥필터 삽입이 90일 사망률을 감소시켰다는 보고도 있다[4].
전신적 혈전용해치료의 실패
광범위 폐색전증에서 혈전용해치료를 시행하더라도 약 10% 정도에서 성공적인 혈전용해가 이루어지지 않는데 이 경우는 혈전용해치료를 다시 시행하는 것보다는 외과적 색전제거술이 더 성적이 좋은 것으로 소규모 연구에서 보고된 바 있다[16]. 최근 ECMO가 광범위 폐색전증의 치료에 이용되면서 ECMO 및 외과적 색전제거술이 이용 가능한 치료전략으로 부상하고 있다[17].
외과적 색전제거술
폐색전의 위치가 외과적으로 접근이 용이한 폐동맥의 큰 분지이면서(centrally located) 혈전용해치료가 금기이거나 실패한 경우는 외과적 색전제거술의 적응이 된다[18]. 이외에도 사망률이 30%에 달하는 우심방 및 우심실에 clot-in-transit 상태의 혈전이 관찰되는 경우와 뇌졸중 및 사망률이 높은 큰 열린타원구멍(patent foramen ovale)이 있는 경우도 외과적 색전제거술이 고려되어야 한다[18,19]. 외과적 색전제거술의 사망률은 1985년 이전에는 30% 정도였으나 최근에는 8% 미만으로 비교적 양호한 성적을 보여주고 있다[20].
카테터-유도 혈전용해(catheter-directed thrombolysis, CDT)
혈전용해치료가 금기이거나 실패한 경우에 특히, 동반질환이나 노령 등으로 외과적 색전제거술이 힘든 경우에는 CDT가 유용한 대안이 될 수 있다. CDT는 카테터를 폐동맥으로 삽입하여 색전 부위를 지나서 거취시키고, 카테터의 측면의 여러 개 구멍으로 혈전용해제를 주입하여 국소적인 혈전용해를 시행하는 것이다. CDT는 이와 함께 혈전분쇄(thrombus fragmentation), 흐름용해(rheolytic), 회전(rotational), 흡입(suction) 혈전제거술을 시행할 수 있다는 장점이 있고 전신적 혈전용해치료에서 보다 적은 양의 혈전용해제(부하용량 2-5 mg + 유지용량 1 mg/hr [12-24시간])를 투여하기 때문에 출혈의 위험성을 감소시킬 수 있다는 이점이 있다[21,22]. 최근에는 카테터를 통하여 초음파를 이용해서 피떡 내로 혈전용해제가 보다 효율적으로 침투하도록 하는 방법(ultrasound-assisted CDT)도 소개되었다[21,23].
체외막산소공급(Extracoporeal membrane oxygenation, ECMO)
ECMO는 광범위 폐색전증 환자의 우심실의 부담을 감소시키면서 산소공급을 원활히 하여 우심실의 회복을 가능하게 해줄 것으로 기대된다[24]. 지금까지 광범위 폐색전증 환자에서 ECMO를 이용하여 치료 성적을 향상시켰다는 다수의 보고(case report 및 case series)가 있으나 무작위대조시험과 같은 체계적인 연구는 없는 실정이다[17]. ECMO는 외과적 색전제거술 전에 환자의 안정화, CDT 시행 전의 보조요법, 소생술, 수술 및 CDT 후의 보조요법, 이외에도 혈전용해를 위한 다른 치료 없이 ECMO만 보조요법으로 사용되는 경우도 있다[17]. 광범위 폐색전증도 일종의 심장성 쇼크이므로 대개 정맥동맥(venoarterial) ECMO를 사용하게 되고 대부분 증례보고나 소수의 환자들을 대상으로 한 연구지만 성공률이 약 70%인 것으로 보고된 바 있다[17].
폐색전증 반응팀(Pulmonary embolism response team, PERT)
일반적으로 폐색전증이 진단되면 위험계층화(risk stratification)의 과정을 거쳐 항응고치료와 함께 혈전용해치료 여부를 결정해야 하고 더 나아가 전신적 혈전용해, 외과적 혈전제거술, CDT, ECMO 등의 치료전략을 빠른 시간 내에 수립해야 한다. 그러나 임상의 혼자서 이러한 결정을 하는데 상당한 어려움이 있다. 따라서 병원 내에 호흡기내과, 순환기내과, 흉부외과, 혈관외과, 영상의학과, 혈액내과 등의 다양한 분야의 전문가들로 구성된 폐색전증 반응팀(pulmonary embolism response team, PERT)를 운영하면 폐색전증 환자가 발생시에 보다 효과적인 치료전략을 세워서 치료방법을 결정할 수 있을 것으로 기대된다[25]. 최근에 미국에는 이러한 팀을 운영하는 곳이 증가하고 있고, 치료성적의 향상을 가져오리라고 기대되고 있다[26].
결론
광범위 폐색전증의 치료는 출혈의 고위험군이 아니라면 UFH를 이용한 항응고제 투여와 함께 alteplase (부하용량 10 mg 정주 + 90 mg 지속정주) 투여가 표준요법인데, 경우에 따라서 저용량 alteplase 투여, alteplase 부하용량투여, LMWH + alteplase 투여 등의 다소 변형된 치료도 가능한 방법이 될 수 있다. 그러나 혈전용해치료가 금기이거나 실패한 경우는 외과적 색전제거술이나 CDT가 가능하며 혈전용해와 더불어 ECMO를 포함한 다양한 보조요법을 치료에 이용할 수 있다.