백혈구, 내피세포 혈소판의 상호작용에 의한 출혈과 지혈
Interplay of Leukocyte, Endothelial Cell and Platelet in Hemorrhage and Hemostasis
Article information
Trans Abstract
The canonical hemostatic function of platelet includes the formation of hemostatic aggregate which then is reinforced by intervening and wrapping fibrin clot. It explains well how our bodies react to direct and physical insults to tissues and vessels therein. On the other hand, vascular integrity is often breached in rather occult manners such as inflammation associated bleeding of thrombocytopenic patients. Bleeding in animals induced by manipulation of certain genes can also be regarded as such. In these cases, the picture of hemostasis is different from conventional understanding. Numbers of experimental results were published regarding the role of leukocytes in thrombus formation. Considering that most occlusive vascular diseases harbor inflammatory components as pathogenic mechanism, the involvement of leukocytes in thrombosis is not astonishing. Interestingly, leukocytes are also involved hemorrhagic manifestation of thrombocytopenia or inflammatory disease animal models. An intriguing aspect of those studies is that hemorrhage is strongly associated with leukocyte extravasation both chronologically and geographically. Whether a passage of leukocyte through the vessel wall functions as the channel of hemorrhage is not known. The exact role of platelets in preventing this kind of bleeding is also still unkown. The link between platelet aggregation and the vascular integrity is seemingly absent in those studies. Evidences still need to accumulate for mechanistic understanding of this new kind of hemostasis.
서론
조직 손상에 의한 출혈과 이에 따른 지혈 반응의 작동 기전은 오랜 기간 실험과 임상 연구에 의해 그 이론적 골격이 다듬어져 왔다. 이는 혈관의 연속성 또는 완전성이 물리적으로 단절됨을 전제로 하며, 혈소판의 부착과 응집에 의한 출혈 경로의 일차적 폐쇄와 더불어 응고인자계 활성화로 인해 혈소판, 혈구세포, 섬유소응괴로 구성된 안정적 지혈괴가 형성되는 과정으로 요약할 수 있다. 이러한 이론적 배경 하에 수술이나 침습적 의료시술 또는 외상에 의한 출혈과 이에 따른 부작용에 대처하기 위한 치료 방법 또한 잘 정립되어 있다. 하지만 염증성 질환이나 면역성 혈소판 감소증 또는 선천적/2차적 혈소판 기능이상으로 인한 미세 혈관에서의 자연적 조직내 출혈이 어떠한 기전으로 발생하는지 아직 잘 알려져 있지 않은 실정이다. 이는 단순히 혈관 연속/완전성의 손실만으로 발생하는 현상이 아니기 때문이다. 최근 백혈구의 혈관외유출이 출혈과 관련되어 있음을 보이고 출혈 양태에 따라 작용하는 혈소판의 지혈 작용 기전이 다름을 나타내는 연구 결과들이 보고되었다. 이에, 향후 미세 혈관 출혈에 대한 기전적, 임상적 연구의 계기를 마련하고자 앞서 언급한 연구 결과들을 간단히 소개하고자 한다.
혈구누출
혈구누출은(diapedesis) 혈액 내 백혈구가 혈관 밖 조직으로 빠져나가는 작용을 말한다. 일반적으로 혈구누출은 염증반응의 한 요소로서 백혈구가 혈관에서 염증이 발생한 조직으로 빠져나가는 과정을 의미한다[1]. 염증과 큰 관련성 없이 발생 과정이나 생리 현상의 일환으로서 혈구누출이 일어나기도 하는데, 일례로 림프절과 같은 림프조직을 형성하기 위해선 림프구가 혈액에서 림프조직으로 빠져나가야 한다[2]. 림프구는 림프절 내 고내피세정맥(high endothelial venule)을 통해 림프조직으로 빠져나가며 이 과정에 림프구의 혈구누출 현상이 일어난다. 고내피세정맥 림프구누출 기전에 실험적 조작 또는 유전 변이로 이상이 생기면 림프조직 형성이 잘 안되거나 면역기능이 저하될 뿐만 아니라 림프절 내 출혈이 발생할 수 있다. 염증 조직에서 증가하는 호중구나 단핵구 혈구누출은 선천면역(innate immunity) 작용의 시작점으로서 의미를 갖고 있다. 혈구누출이 일어나기 위해선, 그 전 단계로 흘러가는 혈액 내 백혈구가 내피세포 표면의 E-selectin이나 P-selectin과 결합하여 멈추어 서야 하며(capture) 포착된 백혈구는 혈류 방향으로 혈관 표면에서 회전이동(rolling)을 한다(Fig. 1A). 이 단계에서 염증 부위의 케모카인(chemokine) 등에 의해 백혈구가 활성화되면 인테그린(integrin)의 구조변화와 함께 인테그린과 내피세포 표면 부착분자(adhesion molecule) 간에 강하고 안정된 결합이 형성된다[3]. 다음 단계로 내피세포 표면의 백혈구가 혈관벽을 따라 이동(crawling)하다가 적당한 위치에 이르게 되면 내피세포 사이나 내피세포를 통과해 혈관 속을 빠져나가는데 이를 혈구누출(diapedesis)라 한다[1]. 백혈구가 내피세포 및 기저막을 통과하는 기전은 정확히 알려져 있지 않은데, 이 과정에 관계하는 세포간 결합과 이를 매개하는 부착분자들은 일부 밝혀졌다[1]. 혈구누출과정에서 내피세포 사이 간격 형성을 위해서는 내피세포 VE-Cadherin 간 동종 결합의 시간적 조절이 중요하다. 백혈구누출을 위해 VE-cadherin과 결합되어 있는 plakoglobin이 탈인산화 되어야 함이 알려져 있는데, plakoglobin은 α-catenin을 통해 VE-cadherin을 세포골격에 연결해 주는 역할을 한다[4]. 염증과 관련된 혈관의 투과성 또한 VE-cadherin의 인산화 성상에 의해 조절되지만 혈구유출과는 별도의 기전이 작용하는 것으로 알려져 있다[5]. 내피세포와 백혈구의 다양한 부착분자들 간 결합은 백혈구가 내피세포 및 기저막층을 통과하는 과정에 혈액 성분이 혈관 외로 유출되는 것을 막는데 중요한 역할을 하기도 하지만 백혈구의 내피세포 통과를 유도하는 역할도 한다. 이에 따라 유전자 조작 기법이나 항체를 이용해 부착분자들의 기능을 억제할 경우 혈구누출 과정의 백혈구가 내피세포와 기저막 사이 일정한 위치에서 멈춰 스는 현상을 관찰할 수 있다[1].
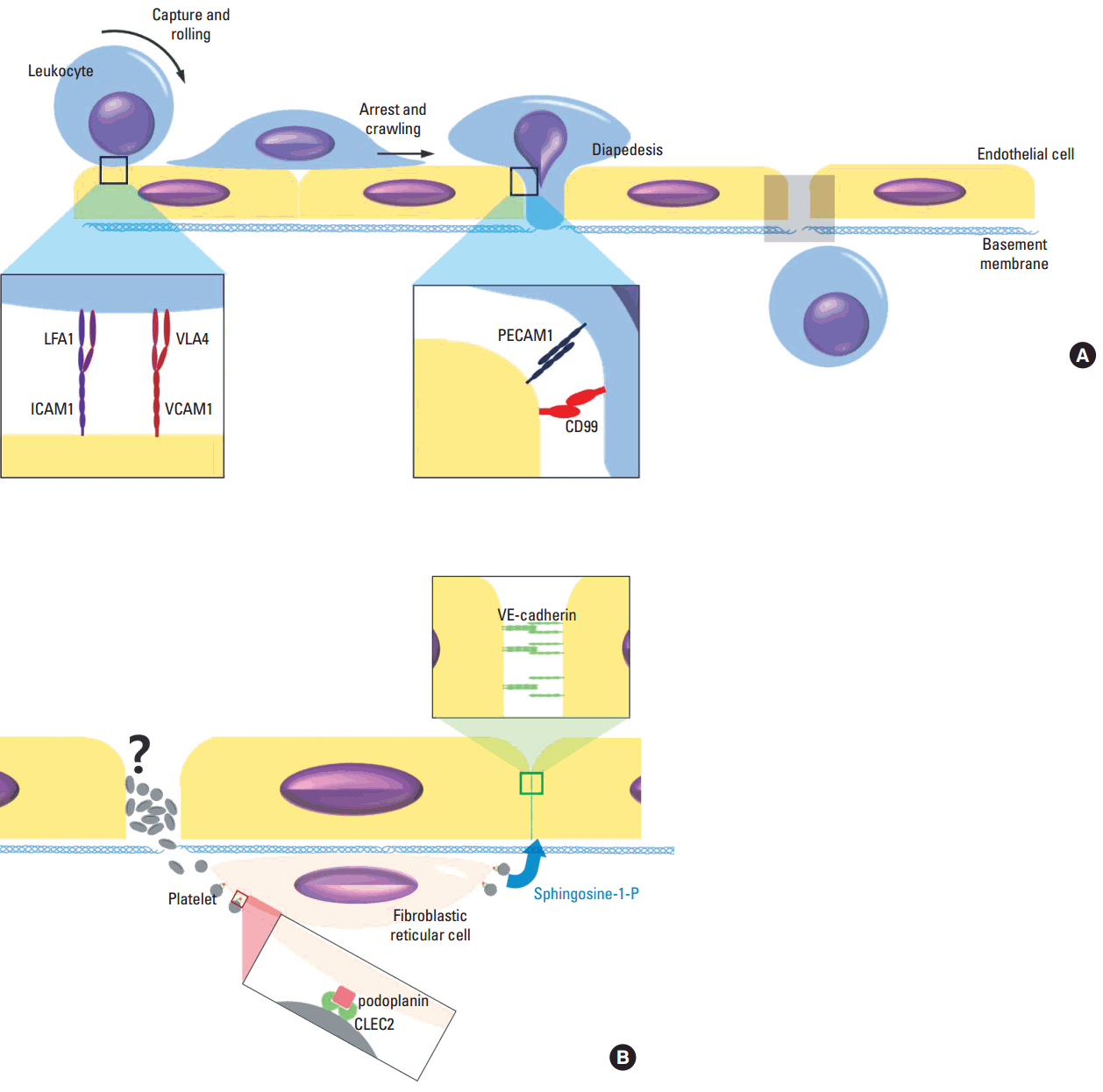
The extravasation of leukocytes and the maintenance of vascular integrity. The endothelial cells activated by inflammatory stimulation express E-selectin and P-selectin, the binding ligands of which include PSGL1 on leukocytes surface. The selectins capture circulating leukocytes. Under the effect of chemokines and other inflammatory mediators, integrins (e.g. LFA1, VLA4) are activated to bind cell adhesion molecules (e.g. ICAM1, VCAM1) on endothelial cells and stabilize the leukocyte-endothelial binding. The firmly bound leukocyte then crawl on the vascular wall to find the proper location to exit the blood vessel (i.e. diapedesis). The gap between or penetration through the endothelial cells for leukocyte passage remain blood proof by still unknown mechanisms. Probably homophilic and heterophilic interactions between various adhesion molecules contribute to the vascular integrity (A). Platelets are essential in preventing hemorrhage causally associated with diapedesis both in physiologic and inflammatory circumstances. How much the canonical hemostatic platelet functions including platelet aggregation contribute to this is not known. The interaction of FRC PDPN and CLEC2 of platelet induce sphingosine-1-P secretion from platelet and this stimulates endothelial cell to upregulate and maintain VE-cadherin expression and vascular integrity (B).
백혈구와 혈전 형성
혈소판과 섬유소응괴 형성은 지혈에 작용하는 주요 작동 기제이며 동시에 혈전증 발생 시 혈관 내 혈전을 구성하는 주된 세포 및 기질 성분이다. 이로부터 혈관 내 혈전 발생 과정과 기본적 지혈 작용 기전 간에 유사성이 많음은 충분히 예상할 수 있다. 하지만 혈소판과 응고인자들의 작용과 더불어 백혈구, 특히 호중구와 단핵구의 역할이 혈관 내 혈전 발생에 중요하다는 사실이 몇차례의 동물 실험을 통해 알려지게 되었다[6,7]. 혈소판, 백혈구, 응고작용 모두 혈전 형성을 위해 필수적인 요소들이나 2-광자 생체내 현미경 관찰에 의하면, 혈관벽의 자극 또는 손상 후 혈관 표면에서 가장 먼저 관찰되는 것은 호중구이다[8,9]. 혈전 형성 과정에 백혈구가 어느 단계에서 어떠한 역할을 하는지 정확히 알려져 있지는 않으나 호중구를 고갈시키거나 항체(e.g. 항 ICAM 항체)를 사용해 내피세포와의 결합을 방해할 경우 혈전 형성이 억제 되는 사실로부터 백혈구가 혈관 내 혈전 형성에 있어 능동적 필수 기능 요소임을 알 수 있다. 흥미롭게도 이러한 백혈구의 혈전 형성 작용은 동맥 혈전과 심부정맥혈전증 모델 모두에서 관찰된다[8,9]. 물론 혈소판이나 섬유소응괴 형성이 혈전 형성에 필수적인 역할을 한다는 사실 또한 간과하여서는 안 된다. 혈소판과 백혈구 그리고 응고인자 간 상호 작용 또한 혈전 형성에 중요한 역할을 한다. 활성화된 혈소판은 호중구를 직접 자극하여 neutrophil extracellular trap (NET) 형성을 유도한다. DNA와 히스톤의 무정형 침착물인 NET는 혈전 또는 섬유소응괴의 구조적 골격 역할을 하는 것으로 알려져 있다[10-12]. NET를 구성하는 DNA의 음하전으로 인해 12번 응고인자와 내인성 응고계가 활성화 될 가능성이 계속 언급되고는 있으나 이에 대한 실험적 증거가 제시된 바는 없으며 내인성 응고계 외에 NET가 응고인자에 미치는 영향에 대해선 별로 알려지지 않았다. 백혈구는 또한 혈전 발생 과정에서 외인성 응고계 활성을 유발하는 조직인자(tissue factor)의 공급원으로 작용한다. 내피세포도 활성화 되면 조직인자를 표현할 수 있으나 내피세포가 아닌 백혈구가 혈전증과 관련된 조직인자의 주요 원천이라는 사실은 조직인자 넉아웃 생쥐 골수이식을 통해 확인할 수 있다[8,9]. 백혈구 중 단핵구 또는 단핵구 유래 미세입자가 조직인자를 표현하고 P-selectin, PSGL1 결합을 통해 혈소판과 결합하여 혈전 내 응고인자 활성을 유도하는 것으로 알려져 있다[13]. 이와 더불어 소동맥 혈전 형성 실험에서는 호중구 유래 조직인자의 중요성이 새로이 밝혀지기도 하였다[8].
호중구 누출을 동반한 출혈
저혈소판증을 유도한 생쥐에 자외선이나 면역복합체로 피부 염증을 유발할 경우 피하조직 내 미만성 출혈을 유발할 수 있는데, 이는 염증이 출혈의 원인임을 나타내는 결과들이며 저혈소판혈증을 보이는 환자의 출혈 기전을 이해하는 데 적용할 수 있다[14,15]. 염증에 의해 출혈이 발생하는 것을 염증과 동반된 혈관 투과성 증가로 설명할 수도 있을 것이다. 하지만 저혈소판증 생쥐에 염증 매개 물질을 처치해 혈관투과성을 높일 경우 혈장에 용해되어 있는 비세포성 성분들은 유출되지만 적혈구를 포함한 혈구들의 출혈은 일어나지 않는다[16]. 반면 염증을 유발하면서 호중구를 제거하거나 호중구의 혈관 부착 또는 이동을 억제하는 경우 앞에서와 같은 출혈은 발생하지 않는다[16]. 이는 내피세포에서 서로 다른 VE-cadherin 결합 조절 기전이 각각 혈관 투과성 조절과 백혈구누출에 관여한다는 사실과 일치하는 결과이다[5]. 이와 더불어 놀라운 사실은 출혈이 발생하는 조직 내 위치가 호중구의 혈구유출이 일어난 부위와 일치한다는 것이다. 이러한 관찰이 호중구유출 과정에 생기는 내피세포간 간격이 출혈 경로가 됨을 의미하는 지는 향후 추가 연구가 있어야 할 것이다. 역설적으로 저혈소판혈증 생쥐는 정상혈소판수의 대조군에 비해 염증에 의한 호중구유출이 저하되어, 조직 내 출혈 위치인 호중구유출 부위가 대조군에 비해 유의하게 적게 관찰된다. 이처럼 외견상 출혈 경로 역할을 하는 호중구유출의 수는 줄었는데도 출혈이 오히려 증가하는 이유가 단순히 혈소판이 혈관벽에 생긴 공동을 제대로 메우지 못하기 때문인 것인지 아직 알려진 바가 없다(Fig. 1B). 최근 염증으로 혈관 표면에 붙은 호중구가 이동축 후미에서 혈소판과 결합하고 호중구, 혈소판 결합이 호중구 운동성에 영향을 미친다는 사실이 발표되었는데, 이는 호중구누출에 의한 출혈 기전에 대해 시사하는 바가 적지 않다[17]. 호중구 후미의 혈소판 결합은 첨단부와 달리 P-selectin과 PSGL1 간의 결합에 의해 매개되는데, 이 부위에서 혈소판과 결합하지 못한 호중구는 PSGL1 하위 신호가 활성화 되지 않아 염증 부위를 향한 호중구 이동의 방향성을 상당히 상실한다. 그러므로, 저혈소판혈증에 의한 혈소판 지혈괴 형성 부진과 더불어, 혈소판과 결합하지 못한 호중구의 운동성 및 호중구누출 기능 변화와 호중구누출 부위 출혈의 관련 가능성에 대한 연구가 필요할 것이다.
림프구 누출에 따른 림프절내 출혈
호중구누출에 의한 염증 부위 출혈과 달리 podoplanin (PDPN) 유전자(Pdpn) 넉아웃 생쥐의 림프구누출과 동반된 장간막 림프절내 출혈은 혈관 투과성 증가를 동반하기 때문에 혈관 연속성 이상 또는 파괴와 관련된 출혈로 생각할 수 있다[18]. 출혈이 림프구누출에 의해 유발되기 때문에 림프구가 결핍(Rag-/-)된 생쥐에서는 출혈이 발생하지 않는다. 고내피세정맥은 다른 혈관과 달리 혈관주위세포(pericyte)가 없다. 혈관주위세포 대신 림프절의 구조적 골격 역할을 하는 PDPN 양성 섬유모그물세포(fibroblastic reticular cell, FRC)가 고내피세정맥 주위를 감싸고 있다[19]. PDPN의 리간드인 CLEC2 유전자 조작 생쥐의 장간막 림프절을 관찰한 결과 고내피세정맥 주위 섬유모그물세포 PDPN과 혈소판 CLEC2 간 결합이 림프구 유출 과정에서 고내피세정맥의 연속성 유지 및 투과성 조절에 중요한 역할을 함이 밝혀졌다. 혈소판이 림프구누출 부위에 존재하며 혈관 주위 세포와 붙어 있기는 하나, 고내피세정맥 연속성 유지를 단순히 혈소판의 응집작용에 의한 혈구누출공 내 지혈괴 형성만으로 설명할 수는 없다. 혈소판 응집을 억제해도 혈소판이 충분하면 출혈이 일어나지 않기 때문이다. 혈소판이 림프절 내 고내피세정맥의 연속성을 유지하는 것은 내피세포의 VE-cadherin 발현을 유도하기 때문이다[18]. 이러한 혈소판의 작용은 당지질인 스핑고신-1-인산(sphingosine-1-phosphate)에 의해 매개되는데 혈소판은 스핑고신-1-인산을 생산, 저장하고 있으며 PDPN-CLEC2 결합에 따른 CLEC2 신호체계 활성화로 이를 분비한다. 혈소판에서 분비된 스핑고신-1-인산은 스핑고신-1-인산 수용체를 통해 내피세포의 VE-cadherin 발현을 유도하며, 증가된 내피세포 VE-cadherin 간 동종 결합은 혈관 연속성을 유지하는 주요 기제이다(Fig. 1B) [18].
혈소판 활성 경로와 출혈
림프절 고내피세정맥의 림프구누출 관련 출혈 연구의 결과들은 혈관의 연속성 유지에 혈소판이 중요한 역할을 함을 나타낸다. 하지만 앞서 언급한 바와 같이 혈소판 응집반응은 혈관 연속성을 유지하는데 제한적 역할만을 하고 있을 뿐이다. 혈관 투과성 조절 및 연속성을 위해선 CLEC2 관련 혈소판 활성만으로 충분한 효과를 얻을 수 있다[18]. 유사한 현상을 림프절 외에 생쥐의 피부나 폐의 염증 유발 모델에서도 관찰할 수 있다. CLEC2외에 콜라겐 (collagen) 수용체인 GPVI에 의한 혈소판 활성 또한 염증 반응 하에서 혈관 연속성을 유지하고 출혈을 예방하는 역할을 할 수 있는데 두 수용체는 모두 면역수용체 타이로신-기반 활성화 모티브(immunoreceptor tyrosine-based activation motif, ITAM) 신호전달계에 속한다는 공통점을 갖고 있다[20]. 반면 같은 염증 모델에서, 혈소판 응집에 중요한 나머지 혈소판 수용체들, 즉 G 단백질 결합 수용체(G protein coupled receptor, GPCR)인 ADP 수용체, thromboxane A2 수용체 또는 트롬빈 수용체(protease activated receptor 4, PAR4) 등을 통한 혈소판 활성화는 혈관 연속성을 유지하는데 별다른 역할을 하지 못한다[20]. 혈소판 CLEC2가 소실될 경우 염증 조직의 혈관 연속성이 제대로 유지 되지 못하는 사실로부터 정상 혈소판의 CLEC2 신호전달계가 지속적으로 활성화 되어 있음을 알 수 있다. 하지만 CLEC2의 리간드인 podoplanin이 림프절이나 신장등 일부 조직에서만 표현되기 때문에 CLEC2가 어떠한 기전에 의해 지속적 활성을 유지하는지 그리고 podoplanin 외에 다른 CLEC2 리간드가 존재하는지 알려진 바가 없다. 한편, 생쥐 뇌졸중 모델에서는 혈소판 ITAM 활성 관련 결과와 다른 출혈 양상을 관찰할 수 있다. 피부나 폐 조직 내 혈관 연속성 유지와 출혈 예방에 GPCR 경유 혈소판 활성화가 필수조건이 아닌 것과 마찬가지로 과립이 결핍된 혈소판 또한 동일 조직의 혈관 연속성 유지나 출혈 예방에 별다른 영향을 미치지 않는다[21]. 치밀과립(dense granule)과 알파과립(α granule)이 모두 결핍된 이중 넉아웃(Unc13d -/-, Nbeal2 -/-) 생쥐의 혈소판 응집반응 이상을 보이나 피부나 폐의 염증 모델에서 혈관 연속성을 유지하는 데에는 별다른 모자람이 없다[21]. 하지만 일과성 중뇌동맥 폐쇄(transient middle cerebral artery occlusion) 뇌졸중 모델에서는 정상 생쥐에 비해 과립 결핍 혈소판 생쥐가 뇌혈관 출혈 발생 및 사망률을 유의하게 높이는 효과를 보인다[21]. 이는 조직의 종류나 염증/손상 원인/기전에 따라 이에 대응하고 출혈을 방지하는 혈소판의 지혈 기전이 다를 수 있음을 나타내는 결과이다.
결론
직접적이고 물리적인 조직 손상 외에도 염증 반응을 포함한 다양한 병리기전에 의해 조직 내 출혈이 발생할 수 있다. 또한 이러한 각각의 병적 상황에 대처하는 혈소판의 혈관 연속성 유지 및 출혈 방지 기전 또한 다양할 수 있다. 제한된 양이지만 몇 가지 관련 연구 결과들을 소개함으로써 아직까지 밝혀지지 않은 다양한 지혈 기전 연구의 계기를 마련했으면 한다.